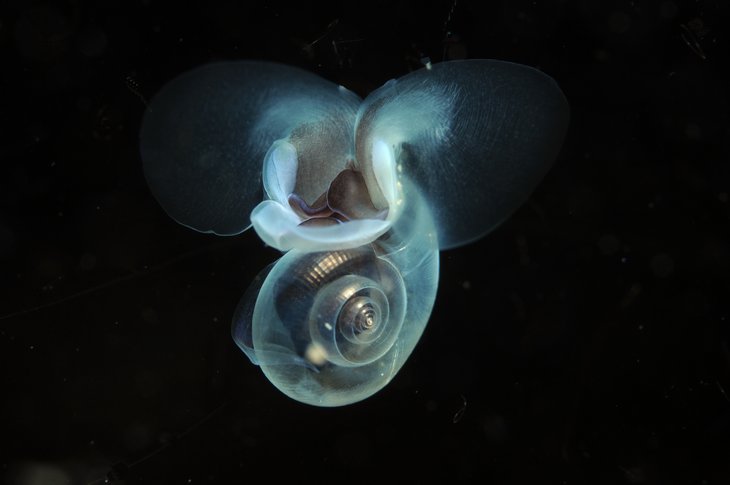
Das Leben im Meer ist auf Kohlendioxid (CO₂) angewiesen. Pflanzen im Meer wie Mikroalgen, Seegräser und Tange nutzen CO₂ für die Photosynthese. Dabei wandeln sie Kohlendioxid mithilfe von Sonnenlicht in Zucker (Glukose) und Sauerstoff um. Der Zucker dient ihnen als Energiequelle und Baustoff, sodass sie wachsen und sich vermehren können. Gleichzeitig dienen Algen, Gräser und Tange als Nahrungsgrundlage für viele andere Meerestiere – für das Zooplankton beispielsweise, von dem sich dann wiederum größere Räuber wie Fische, Bartenwale und Pinguine ernähren.
Der Säuregehalt des Meeres
Meere und Ozeane nehmen CO2 an ihrer Oberfläche auf. Sowie sich das Treibhausgas dabei im Meerwasser löst, kommt es zu einer chemischen Veränderung des Oberflächenwassers. Denn anders als zum Beispiel Sauerstoff, löst sich Kohlendioxid nicht einfach nur im Meerwasser. Eine Teilmenge des Gases reagiert mit den Wassermolekülen und bildet Kohlensäure. Deren Moleküle wiederum spalten sich bis auf ganz wenige Ausnahmen sofort auf: in Hydrogenkarbonat und ein Wasserstoffkation, welches auch als Proton bezeichnet wird.
Die freigesetzten Protonen treiben den Säuregehalt des Wassers in die Höhe. Nimmt der Ozean viel zusätzliches Kohlendioxid aus der Atmosphäre auf, läuft das Meer deshalb Gefahr zu versauern, wodurch sich die Lebensbedingungen für viele Meeresorganismen verschlechtern.
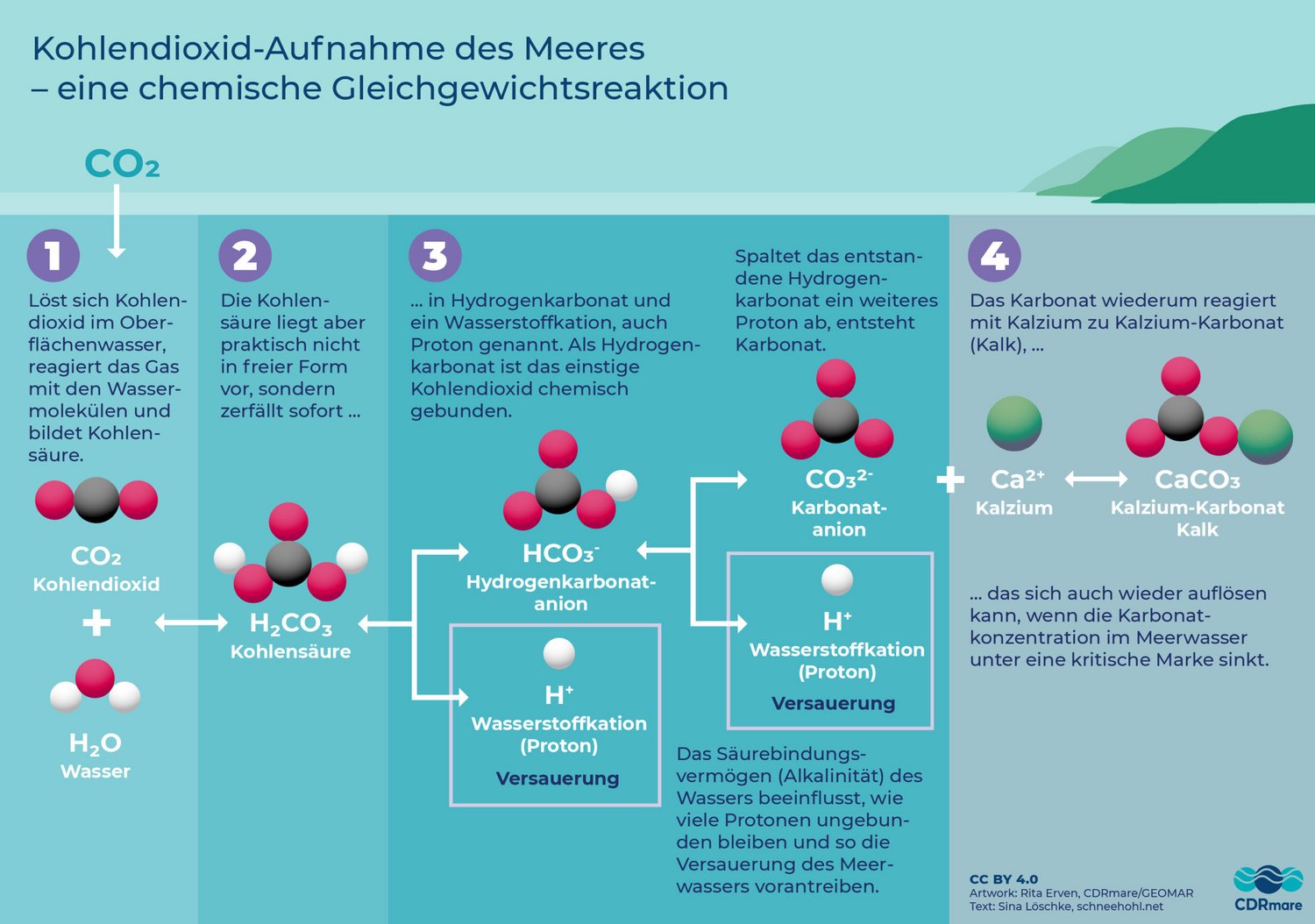
Wie viele Protonen jedoch tatsächlich bei der Kohlensäure-Aufspaltung freigesetzt werden, hängt vom Säurebindungsvermögen des Meerwassers ab. Dieses wird durch mineralische Bestandteile im Wasser bestimmt, die ihren Ursprung vor allem an Land haben. Dort wurden sie über Jahrmillionen aus verwittertem Gestein gelöst und anschließend durch Regenwasser, Bäche und Flüsse in das Meer geschwemmt.
Ist der Anteil dieser eingetragenen Minerale hoch, besitzt das Meerwasser ein hohes Säurebindungsvermögen. Fachleute sprechen von einer hohen Alkalinität des Wassers. In diesem Fall wird eine Vielzahl der Protonen gar nicht erst freigesetzt, sondern bei der Kohlensäure-Aufspaltung sofort durch die eingetragenen Minerale gebunden. Enthält das Wasser jedoch nur wenige mineralische Bestandteile, ist das Säurebindungsvermögen begrenzt. Die Zahl der freien Protonen steigt und das Meer versauert zunehmend.
Je kleiner der pH-Wert des Meerwassers, desto höher seine Versauerung
Gemessen wird die Konzentration der Wasserstoffkationen oder Protonen in einer Lösung mithilfe des sogenannten pH-Wertes. Er gibt an, wie sauer beziehungsweise basisch eine Flüssigkeit ist. Die pH-Wert-Skala reicht dabei von 0 (sehr sauer) bis 14 (sehr basisch). Das bedeutet, je mehr Wasserstoffkationen in einer Lösung vorhanden sind, desto kleiner ist der pH-Wert.
Der mittlere pH-Wert der Meeresoberfläche ist seit Beginn der Industrialisierung vor mehr als 250 Jahren von 8,2 auf 8,1 gesunken. Dieser vermeintlich kleine Schritt auf der logarithmischen pH-Skala entspricht einem realen Anstieg des Säuregehalts um 26 Prozent – eine Veränderung, wie sie die Weltmeere und ihre Bewohner in den letzten Jahrmillionen nicht erlebt haben.
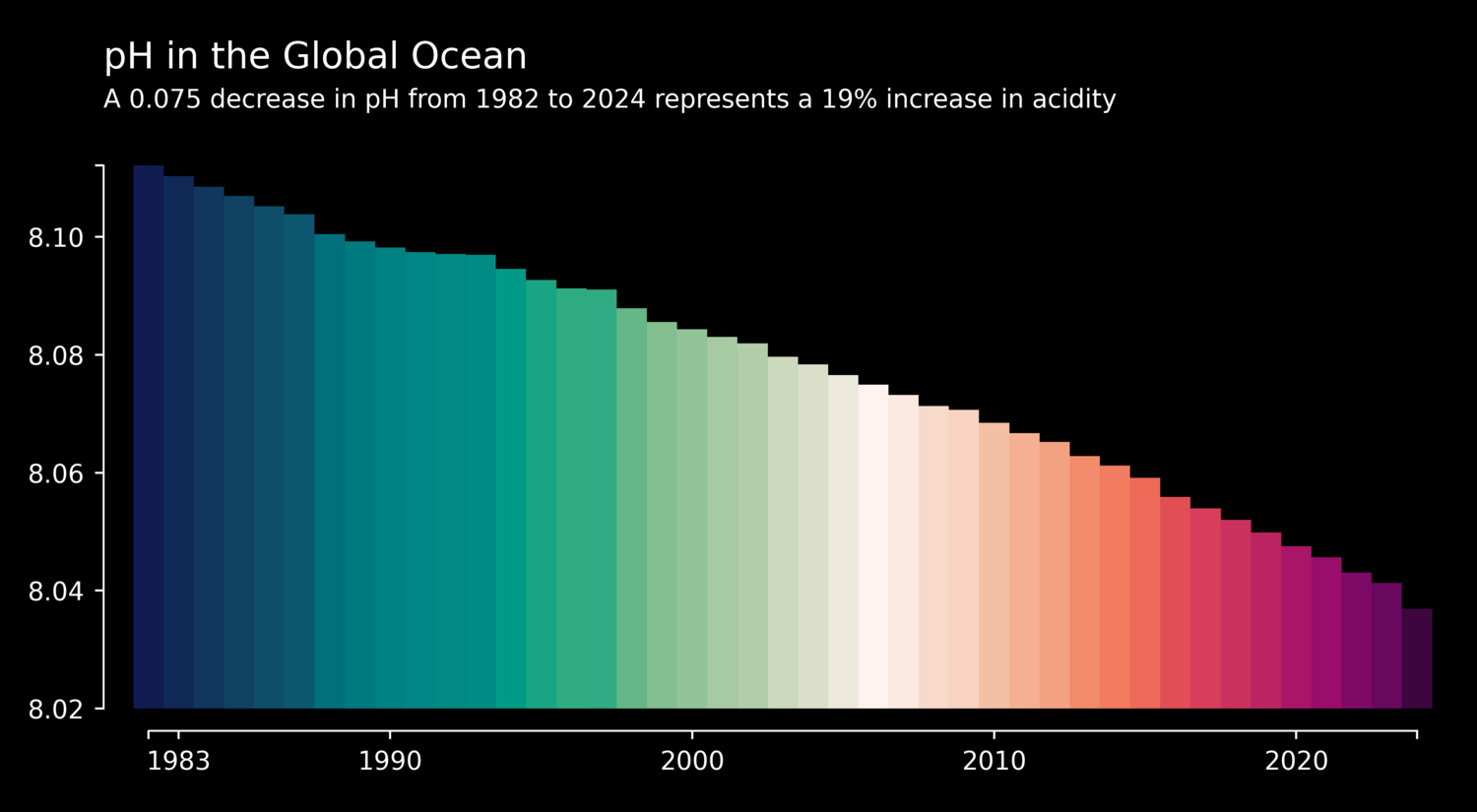
(Bild: Nicolas Gruber & Luke Gregor (ETH Zürich), CC-BY4.0)
Die vielen Folgen der Ozeanversauerung
Die zunehmende Versauerung der Meere wirkt sich auf verschiedene biologische Prozesse aus und somit auf das Leben vieler Meeresbewohner. Durch die abnehmende Verfügbarkeit von Karbonaten im Meerwasser fällt es vor allem kalkbildenden Organismen wie Korallen, Muscheln, Flügelschnecken und Kammerlingen schwerer, ihre Kalkschalen oder -skelette zu bauen. Diese werden dünner und zerbrechlicher. Von Stachelhäutern wie Seeigeln und Seesternen weiß man, dass sie mit zunehmender Versauerung weniger wachsen und früher sterben. Fische sind vor allem als Embryo im Ei sowie als Larve gefährdet. In beiden frühen Entwicklungsstadien besitzen die Tiere nämlich noch keine funktionierende Säure-Base-Regulation.
Unklar ist bislang auch, in welchem Umfang sich die verschiedenen Meereslebewesen an die Ozeanversauerung anpassen können. Einzellige Algen und kleines Zooplankton mit kurzen Fortpflanzungszyklen scheinen besser gewappnet zu sein als größere Lebewesen mit langen Reproduktionszyklen.
CO₂ ist also einerseits lebensnotwendig für Meeresorganismen, andererseits kann ein Ungleichgewicht durch zu viel CO₂ im Wasser das marine Ökosystem empfindlich stören.
- Woods Hole Oceanographic Instituion (WHOI) (o.D.). Know Your Ocean. Ocean Topics - Ocean Acidification. www.whoi.edu/know-your-ocean/ocean-topics/how-the-ocean-works/ocean-chemistry/ocean-acidification/